Превращения веществ и энергии в живых организмах происходит при участии биокатализаторов – ферментов. Первоначально считалось, что ферментативной активностью обладают только белки, однако недавно было доказано и существование РНК-ферментов (рибозимов), впрочем, подавляющее большинство ферментов – всё-таки белки. Подобно всем катализаторам, ферменты ускоряют как прямую, так и обратную реакцию, понижая энергию активации процесса. Химическое равновесие при этом не смещается ни в прямую, ни в обратную сторону.
Однако, в отличие от химических катализаторов, которые, как правило, способны ускорять целый спектр похожих химических реакций, ферменты – высокоспециализированные (специфичные) катализаторы, которые ускоряют одну-две реакции.
Активность ферментов определяется их трёхмерной структурой. Таким образом, любые, даже слабые взаимодействия, нарушающие эту структуру (денатурирующие), будут вызывать инактивацию фермента.
| |
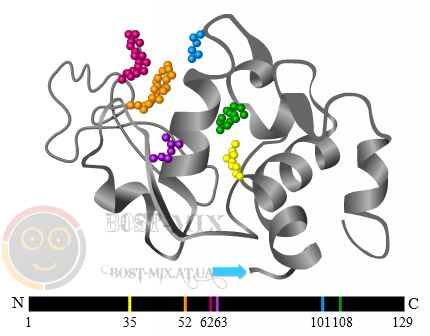
Рис. 1. Активный центр фермента лизоцима в составе его третичной структуры (А) и первичной структуры (В). Аминокислотные остатки, входящие в активный центр, выделены цветом |
Участок фермента, ответственный за каталитическую активность, называется активным центром. Чтобы катализировать реакцию, фермент должен связаться с одним или несколькими субстратами. Белковая цепь фермента сворачивается таким образом, что на поверхности глобулы образуется щель, или впадина, где связываются субстраты. Эта область называется сайтом связывания субстрата и обычно совпадает с активным центром фермента (или находится вблизи него). Некоторые ферменты содержат также сайты связывания кофакторов – низкомолекулярных веществ (или ионов), присутствие которых необходимо для активации фермента. Взаимодействие фермента с субстратом первоначально описывались моделью «ключ–замок», согласно которой специфичность ферментов определяется точным соответствием формы фермента и субстрата (а также расположением заряженных групп, гидрофобных участков). На сегодняшний день более адекватной считается модель «индуцированного соответствия», согласно которой фермент и субстрат в некоторой степени «подстраиваются» друг под друга в ходе взаимодействия. Согласно этой модели, ферменты в основном не жесткие, а гибкие молекулы; активный центр фермента может изменить конформацию после связывания субстрата. Боковые группы аминокислот активного центра принимают такое положение, которое позволяет ферменту выполнить свою каталитическую функцию. В некоторых случаях молекула субстрата также меняет конформацию после связывания в активном центре фермента.